2014年初三化学第三章知识点总结
沈阳中考网:第三章物质构成的奥秘中考考点:构成物质的微粒、元素与符号、物质分类、化学式与其有关计算、元素与人体健康一、微粒的特征1、肉眼看不见,极小(体积小、质量小);
2、在不停的运动(做无规则、高速运动且温度越高运动速率越快);
3、微粒间存在一定的间隙;微粒间隙的大小决定了物质的剧集状态,气体分子间间隙比固体、液体要大,且易压缩。
二、分子、原子、离子
1、分子是保持由分子构成的物质化学性质的最小粒子,但分子不是保持物质化学性质的唯一粒子,因为构成物质的微粒有三种,分子,原子,粒子。
2、原子
(1)原子是化学变化中最小的粒子。化学变化的过程是原子重新组合的过程。
(2)原子的构成为原子核和核外电子,而原子核又由质子和中子组成(有些原子核中不含中子);核电荷数=质子数=核外电子数。
(3)原子的质量主要集中在原子核上;原子的种类是由核电荷数(即质子数)决定。

3、离子
(1)在化学变化中,电中性的原子经常会得到或失去电子而成为带电荷的微粒,这种带电的微粒称为离子。
(2)分类阳离子:带正电荷的离子,如:Na+阴离子:带负电荷的离子,如:Cl-
(3)离子符号的意义(数字2的意义)

4、三种粒子在化学变化中转化关系
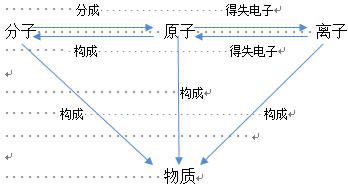
三、核外电子排布
1、核外电子的运动状态被人为的分成了几个电子层,但在每一个电子层上的电子数是不同的:第一层最多能容纳2个电子;第二层最多容纳8个电子;最外层电子数最多不超过8个(如果第一层为最外层时,不超过2个电子)。
2、原子结构示意图
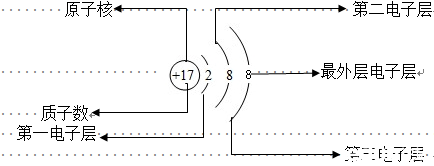
3、原子结构与性质关系
| 原子分类 | 最外层电子数 | 得失电子趋势 | 化学性质 | 举例 |
| 稀有气体原子 | 8个(氦为2个) | 相对稳定,不易得失电子 | 稳定 | He、Ne、Ar等 |
| 金属原子 | 一般少于4个 | 易失去最外层电子 | 不稳定 | Li、Na、K等 |
| 非金属原子 | 一般多余4个 | 易得到电子 | 不稳定 | N、、P、S等 |
四、元素与元素符号
1、元素定义:具有相同核电荷数(即质子数)的同一类原子的总称。
2、地壳中含量位居前四位的元素:氧、硅、铝、铁。
3、生物细胞中含量位居前四位的元素:氧、碳、氢、氮。
4、物质、元素、分子、原子之间的关系: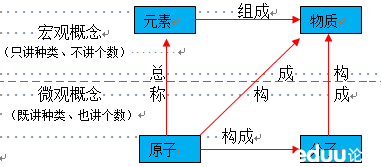
7、元素与人体健康缺钙可能导致骨骼疏松、畸形,易得佝偻病;缺锌会使儿童发育停滞,智力低下,严重时会得侏儒症;缺钴、铁易得贫血病;缺碘或碘过量均会导致甲状腺疾病。但钙吸收过多,容易引起白内障、动脉硬化等;微量的硒可以防癌,过量的硒则是致癌的原因之一。
8、元素周期表
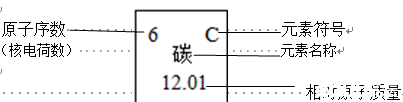
(1)原子序数=核电荷数=质子数=核外电子数
(2)元素周期表眉一横行叫一个周期,位于同一周期中的原子核外电子层数相同。每一纵行叫做一族,同一族中的原子其外层电子数相同。
五、化合价
1、化合物中组成元素的原子个数比是一定的,元素的这一性质就是元素的化合价,化合价有正、负之分。
2、常见元素的化合价:一价氢氯钾钠银,二价氧钙钡镁锌;三铝四硅五价磷,二、三铁,二、四碳;二、四、六硫都齐全,铜、汞二价最常见。莫忘单质价为零。
3、化合价的一般规律
(1)氢元素的化合价通常是+1价,氧元素通常显-2价;
(2)金属元素一般显正价;
(3)非金属与氢或与金属化合时,非金属显负价;
(4)一些元素在不同的物质中显不同化合价;
(5)在化合物中各元素正、负化合价的代数和为0;六、物质简单分类
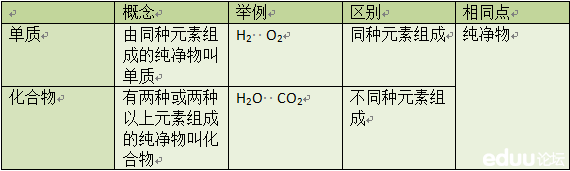
七、化学式的计算1、纯净物的相对分子质量=化学式中各元素原子的相对质量之和2、计算物质组成元素的质量比:化学式中各元素的质量比等于各元素的相对质量与原子个数乘积之比。

点击下载:第三章物质构成的奥秘.pdf
中考化学相关:
第一章:开启化学之门
第二章:身边的化学物质
第三章:物质构成的奥秘
[查看原帖参与讨论]



