2024年中考化学酸碱盐易错点笔记
 点击免费领取中考核心考点资料!
点击免费领取中考核心考点资料!
1.除去食盐水中的CaCl2和Na2SO4杂质的操作有:①加过量的BaCl2溶液;②过滤;③加过量的Na2CO3溶液;④蒸发结晶;⑤加适量盐酸。下列操作顺序正确的是(提示BaSO4、BaCO3难溶于水) (D)
A.③①②⑤④B.①⑤③②④
C.①③⑤④②D.①③②⑤④
解析:粗盐提纯操作顺序题需牢记两点:①先加BaCl2溶液再加Na2CO3溶液;②先过滤后加稀盐酸。
2.氯化钠溶液中含有杂质CaCl2和Na2SO4,依次通过以下操作将其除去①加入过量的氯化钡溶液;②加入过量的碳酸钠溶液;③过滤;④加入适量的盐酸至溶液呈中性。则关于该过程的说法正确的是(D)
A.操作①和②的顺序可以颠倒
B.操作②只除去了Ca2+
C.操作③和④的顺序可以颠倒
D.操作④只除去了CO32-
解析:必须将BaCl2溶液放在Na2CO3溶液之前加入,因为加入Na2CO3溶液需要同时除去Ca2+、Ba2+;A、B不正确。
加入稀盐酸是为了除去CO32-,如果先加稀盐酸再过滤,就会发生如下反应:BaCO3+2HCl=BaCl2+H20+CO2↑;CaCO3+2HCl=CaCl2+H20+CO2↑;反复引入杂质。
3.食盐水中含有杂质CaCl2和Na2SO4,依次加入过量BaCl2和Na2CO3溶液后过滤,滤液中溶质为 ;过滤所用玻璃仪器有烧杯、玻璃棒和 。向食盐水中通NH3和CO2可制得小苏打和一种氮肥,该氮肥的化学式为 。(提示:BaSO4、BaCO3难溶于水)
解析:根据过量BaCl2能与Na2SO4溶液反应生成硫酸钡沉淀和氯化钠,过量Na2C03溶液能与氯化钙、氯化钡溶液反应生成碳酸钙沉淀、碳酸钡沉淀和氯化钠,过滤,滤液中溶质为氯化钠和碳酸钠(过量的)。
过滤所用玻璃仪器有烧杯、玻璃棒和漏斗。
向食盐水中通NH3和CO2可制得小苏打和一种氮肥,由质量守恒定律,反应前后元素的种类不变,该氮肥中含有氮元素和氯元素,应为氯化铵,其化学式为:NH4Cl。
4.除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作有:①加入过量的NaOH溶液,②加入过量的BaCl2溶液,③过滤,④加适量的盐酸;⑤加过量的Na2CO3溶液。
(1)以上操作合理的先后顺序为 (数字序号不能重复使用)。
(2)请写出BaCl2溶液与Na2CO3溶液反应的化学方程式。
答: 。
(3)上述试剂中的Na2CO3不能用K2CO3代替,请说明原因。
答: 。
解析:粗盐提纯操作顺序题需牢记两点:①先加BaCl2溶液再加Na2CO3溶液;②先过滤后加稀盐酸;所以顺序可以为:①②⑤③④、②①⑤③④或②⑤①③④
BaCl2溶液与Na2CO3溶液反应的化学方程式:BaCl2+Na2CO3=BaCO3↓+2NaCl
粗盐提纯问题是除杂的具体化,除杂需要满足不增不减易分离,如果用K2CO3代替Na2CO3就会生成氯化钾,也是杂质。因此可以回答:避免引入新杂质氯化钾(或K+)
5.粗盐中含有的杂质有CaCl2、MgCl2、Na2SO4和泥沙,为除去杂质得到精盐,加水溶解后可按以下顺序操作:①加过量的NaOH溶液;②加过量的BaCl2溶液;③加过量的Na2CO3溶液;④过滤;⑤加足量的盐酸;⑥蒸发结晶。
(1)写出除去Na2SO4的化学方程式 。
(2)以上操作中一共发生 个反应。
解析:
整个粗盐提纯过程发生反应的化学方程式有:
①BaCl2+Na2SO4=2NaCl+BaSO4↓
②MgCl2+2NaOH=2NaCl+Mg(OH)2↓③CaCl2+Na2CO3=2NaCl+CaCO3↓④BaCl2+Na2CO3=2NaCl+BaCO3↓⑤2HCl+Na2CO3=2NaCl+H2O+CO2↑⑥HCl+NaOH=NaCl+H2O
6.为除去氯化钠中的泥沙和CaCl2、MgCl2、Na2SO4杂质,某化学兴趣小组的同学先将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按以下流程进行实验探究。
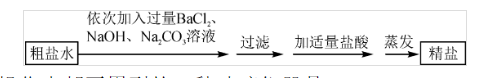
(1)溶解、过滤、蒸发操作中都要用到的一种玻璃仪器是 。
(2)写出一个加入Na2CO3溶液时所发生反应的化学方程式 。
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中含哪些杂质?(BaSO4不溶于水,也不溶于酸)
答: 。
解析:
溶解、过滤、蒸发操作中都要用到玻璃棒,作用分别是:搅拌以加速溶解、引流以防止滤液飞溅、搅拌以防止局部温度过高导致液体飞溅。
加入Na2CO3溶液的作用是同时除去Ca2+、Ba2+,因此反应方程式可以填写:Na2CO3+CaCl2=CaCO3↓+2NaCl或BaCl2+Na2CO3= BaCO3↓+2NaCl。
如果先加稀盐酸再过滤,就会发生如下反应:
BaCO3+2HCl=BaCl2+H20+CO2↑;
CaCO3+2HCl=CaCl2+H20+CO2↑;
Mg(OH)2+2HCl=MgCl2+2H2O;
因此所得精盐产品中杂质有CaCl2、MgCl2、BaCl2
7.“粗盐提纯”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等杂质。某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:
部分物质的溶解性表(室温)
|
OH- |
Cl- |
SO4 |
CO32- | |
|
H+ |
溶、挥 |
溶 |
溶、挥 |
|
|
Ba2+ |
溶 |
溶 |
不溶 |
不溶 |
|
Ca2+ |
微溶 |
溶 |
微溶 |
不溶 |
|
Mg2+ |
不溶 |
溶 |
溶 |
微溶 |
(1)溶解、过滤和蒸发操作中都用到一种玻璃仪器,该仪器在蒸发操作中的作用是什么?
答: 。
(2)加入Na2CO3溶液的目的是什么?
答: 。
(3)以上方案还需完善,请说明原因并加以补充。
答:
解析:
溶解、过滤、蒸发操作中都要用到玻璃棒,作用分别是:搅拌以加速溶解、引流以防止滤液飞溅、搅拌以防止局部温度过高导致液体飞溅。
当过滤之后,我们会发现滤液里边还有刚才除杂加入的过量的氢氧化钠和碳酸钠,所以必须除去。由于在操作过程中加入的试剂均过量,因此过滤后的滤液中除了含有氯化钠外,还含有过量的碳酸钠和氢氧化钠;应该在滤液中加入适量的盐酸再进行蒸发操作。
8.粗盐中除主要成分NaCl外常含有少量的MgCl2、CaCl2、MgSO4杂质,某同学先将粗盐配制成溶液,然后从碳酸钠溶液、稀盐酸、硝酸钡溶液、碳酸钾溶液和氢氧化钡溶液中选择三种试剂,按以下步骤进行实验除去此粗盐中杂质得到较为纯净的NaCl溶液:
实验Ⅰ:向溶液中加入过量氢氧化钡溶液后过滤,得滤液1;
实验Ⅱ:向滤液1中加过量A后过滤,得滤液2;
实验Ⅲ:向滤液2中滴加适量B,得到较纯净的NaCl溶液.
请回答下列问题:
(1)实验Ⅰ中,所加氢氧化钡溶液要过量的原因是 ;
(2)实验Ⅱ中,有关化学方程式为 ;
(3)B试剂中溶质的化学式为 ;
(4)实验Ⅲ中,试剂加到 时为适量,此时得到较为纯净的NaCl溶液。
解析:
(1)实验Ⅰ中,所加氢氧化钡溶液可以与MgCl2、CaCl2、MgSO4三种杂质中的MgCl2和MgSO4反应,因此所加氢氧化钡溶液要过量的原因是:能除尽氯化镁、硫酸镁(使氯化镁、硫酸镁完全反应)。
(2)实验Ⅱ中,碳酸钠能和氯化钡反应生成碳酸钡沉淀和氯化钠,能和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,能和氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式分别是:BaCl2+Na2CO3═BaCO3↓+2NaCl,Na2CO3+Ba(OH)2═BaCO3↓+2NaOH,Na2CO3+CaCl2═CaCO3↓+2NaCl。
(3)B试剂是稀盐酸,其中溶质氯化氢的化学式为HCl.
(4)实验Ⅲ中,试剂加到刚好不产生气泡时为适量,因为此时溶液中的氢氧化钠和碳酸钠和稀盐酸恰好完全反应,得到较为纯净的NaCl溶液。



