2024年中考化学:“溶液”知识点
 点击免费领取中考核心考点资料!
点击免费领取中考核心考点资料!
一、溶液的形成
1. 溶液
(1)概念:
一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物
(2)特征:
均一性、稳定性
(3)组成
① 溶质:被溶解的物质,可以是固体、液体、气体
② 溶剂:能溶解其他物质的物质。水是最常用的溶剂,汽油、酒精等也可以作溶剂
2. 溶解
(1)吸热:
一些物质溶于水后,整个过程中溶液温度降低,如NH4NO3(或硝酸铵)固体
(2)放热:
一些物质溶于水后,整个过程中溶液温度升高,如NaOH固体、浓H2SO4
(3)吸放热不明显:
多数物质溶于水后,整个过程中溶液温度变化不明显,如NaCl固体
【注意】
a. 氧化钙遇水放热是因为氧化钙与水反应放热
b. 吸热、放热现象通常会引起密闭容器内压强的变化
二、乳化
1. 乳化现象:
洗涤剂等乳化剂能使植物油等在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强,这种现象称为乳化
2. 应用:
利用洗涤剂的乳化作用清洗餐具上的油污等
三、饱和溶液与不饱和溶液
1. 概念
(1)不饱和溶液:在一定温度下,一定量溶剂里,还能继续溶解这种溶质的溶液
(2)饱和溶液:在一定温度下,一定量溶剂里,不能继续溶解这种溶质的溶液
2. 判断依据
(1)根据能否继续溶解该物质判断:在温度、溶剂的量不变时,继续向溶液中加入该物质,观察是否溶解,若不再溶解则为饱和溶液,反之,则为不饱和溶液
(2)根据溶解的量判断
3. 转化

【注意】
析出晶体后的溶液一定是同条件下的饱和溶液
四、结晶
1. 概念:
溶质从溶液中以晶体的形式析出的过程
2. 方法
(1)蒸发结晶:通过蒸发溶剂的方法使溶质析出,适用于溶解度受温度影响较小的物质,如氯化钠
(2)降温结晶(冷却热饱和溶液):通过降温的方法使溶质析出,适用于溶解度随温度升高而明显增大的物质,如硝酸钾
五、溶解度及溶解度曲线
1. 溶解度
(1)固体溶解度
① 概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
② 影响因素
内因:溶质、溶剂本身的性质
外因:温度【多数固体物质溶解度随温度的升高而增大,但NaCl(变化不大)、Ca(OH)2(降低)等除外】
(2)气体溶解度
① 概念:在压强为101kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积
② 影响因素
内因:溶质、溶剂本身的性质
外因:温度(温度越高,气体的溶解度越小)、压强(压强越大,气体的溶解度越大
2. 溶解度曲线(针对固体溶质)
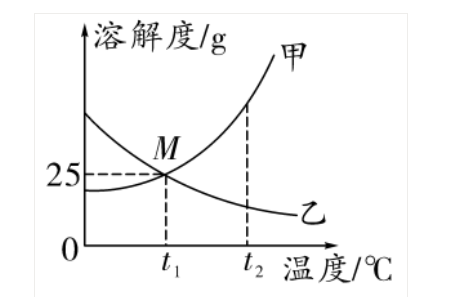
(1)概念:
溶解度随温度变化的曲线。纵坐标表示溶解度,横坐标表示温度
(2)意义
① 点
曲线上的点:表示物质在对应温度下的溶解度
两曲线的交点:表示两物质在某温度下溶解度相等
② 线
曲线的走向表示物质的溶解度随温度改变而变化的趋势
曲线的陡缓表示物质溶解度受温度影响的变化大小
六、溶液的定量组成(浓度)
1. 溶质质量分数的计算公式

2. 溶液的稀释
(1)原理:
稀释前后,溶质质量不变
(2)公式:
A×a%=B×b%(其中a%、b%分别为稀释前后溶质的质量分数,A、B分别为稀释前后溶液的质量,即B=A+加入溶剂的质量)
编辑推荐:




