2023年中考化学:“溶液”知识点
 点击免费领取中考核心考点资料!
点击免费领取中考核心考点资料!
一、溶液的形成
一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物均一性、稳定性
① 溶质:被溶解的物质,可以是固体、液体、气体
② 溶剂:能溶解其他物质的物质。水是最常用的溶剂,汽油、酒精等也可以作溶剂
2. 溶解
一些物质溶于水后,整个过程中溶液温度降低,如NH4NO3(或硝酸铵)固体一些物质溶于水后,整个过程中溶液温度升高,如NaOH固体、浓H2SO4多数物质溶于水后,整个过程中溶液温度变化不明显,如NaCl固体a. 氧化钙遇水放热是因为氧化钙与水反应放热
b. 吸热、放热现象通常会引起密闭容器内压强的变化
二、乳化
洗涤剂等乳化剂能使植物油等在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强,这种现象称为乳化
2. 应用:
利用洗涤剂的乳化作用清洗餐具上的油污等
三、饱和溶液与不饱和溶液
(1)不饱和溶液:在一定温度下,一定量溶剂里,还能继续溶解这种溶质的溶液(2)饱和溶液:在一定温度下,一定量溶剂里,不能继续溶解这种溶质的溶液(1)根据能否继续溶解该物质判断:在温度、溶剂的量不变时,继续向溶液中加入该物质,观察是否溶解,若不再溶解则为饱和溶液,反之,则为不饱和溶液(2)根据溶解的量判断(1)对于大多数溶解度随温度升高而增大的物质:

【注意】
析出晶体后的溶液一定是同条件下的饱和溶液
四、结晶
溶质从溶液中以晶体的形式析出的过程(1)蒸发结晶:通过蒸发溶剂的方法使溶质析出,适用于溶解度受温度影响较小的物质,如氯化钠
(2)降温结晶(冷却热饱和溶液):通过降温的方法使溶质析出,适用于溶解度随温度升高而明显增大的物质,如硝酸钾
五、溶解度及溶解度曲线
① 概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量② 影响因素内因:溶质、溶剂本身的性质外因:温度【多数固体物质溶解度随温度的升高而增大,但NaCl(变化不大)、Ca(OH)2(降低)等除外】① 概念:在压强为101kPa和一定温度时,溶解在1体积水里达到饱和状态时的气体体积② 影响因素内因:溶质、溶剂本身的性质外因:温度(温度越高,气体的溶解度越小)、压强(压强越大,气体的溶解度越大
2. 溶解度曲线(针对固体溶质)
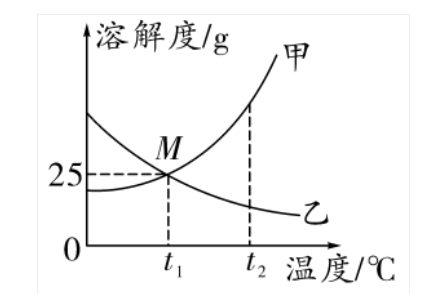
(1)概念:
溶解度随温度变化的曲线。纵坐标表示溶解度,横坐标表示温度
(2)意义
曲线上的点:表示物质在对应温度下的溶解度两曲线的交点:表示两物质在某温度下溶解度相等曲线的走向表示物质的溶解度随温度改变而变化的趋势
曲线的陡缓表示物质溶解度受温度影响的变化大小
六、溶液的定量组成(浓度)

2. 溶液的稀释
稀释前后,溶质质量不变
(2)公式:
A×a%=B×b%(其中a%、b%分别为稀释前后溶质的质量分数,A、B分别为稀释前后溶液的质量,即B=A+加入溶剂的质量)
编辑推荐:




