2023年初三化学:酸碱盐知识点梳理(一)
2023-07-27 16:44:04佚名
 点击免费领取中考核心考点资料!
点击免费领取中考核心考点资料!
第一部分 常见的酸
1. 定义:
在水溶液中解离时产生的阳离子全部是氢离子(或H+)的化合物
2. 常见酸的特性及用途
(1)盐酸
① 浓盐酸具有挥发性,敞口放置时瓶口形成白雾,有刺激性气味;纯净的浓盐酸是无色的液体
② 用途:用于金属除锈、电镀、化工生产等。人体胃液中含有盐酸,可帮助消化
(2)硫酸
① 不易挥发,无味;纯净的浓硫酸是无色、黏稠的油状液体
② 浓硫酸的特性:
吸水性:实验室中常用来作气体干燥剂
脱水性:可使蔗糖、纸张等脱水而炭化
腐蚀性:如果不慎将浓硫酸沾到皮肤上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠(或NaHCO3)溶液
③ 用途:用于金属除锈、生产车用电池、化肥、农药、精炼石油等
3.化学通性(酸5条)
酸具有通性的原因是:在水溶液中都能解离出H+(或氢离子)
(1)与酸碱指示剂反应:
能使紫色石蕊溶液变红,不能使无色酚酞溶液变色
(2)与活泼金属反应:
通式:酸+活泼金属→盐+H2↑(置换反应)
举例:

(3)与某些金属氧化物反应
通式:酸+金属氧化物→盐+H2O(复分解反应)
举例:

(4)与碱反应
通式:酸+碱→盐+H2O(复分解反应)
举例:
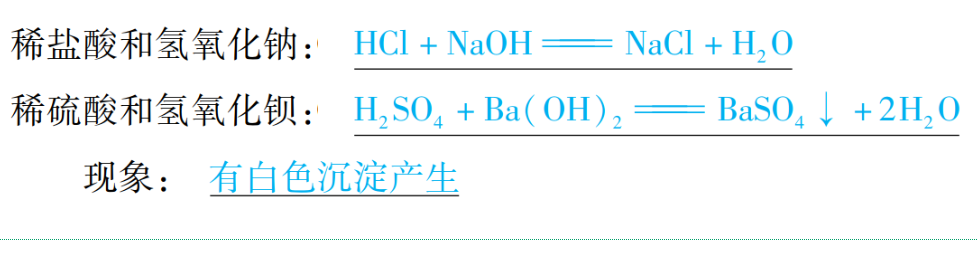
(5)与某些盐反应
通式:酸+盐→新酸+新盐(酸+碳酸盐→新盐+H2O+CO2↑)(复分解反应)
举例:
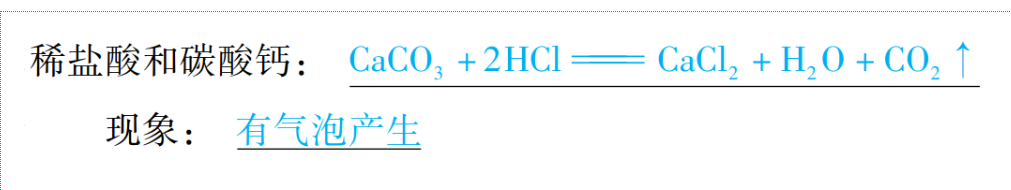
【注意】不同酸具有“个性”的原因是:含有的酸根离子(或阴离子)不同。
如:

编辑推荐:
最新中考资讯、中考政策、考前准备、中考预测、录取分数线等
中考时间线的全部重要节点
尽在"中考网"微信公众号




