2023年初三化学:酸碱盐知识点梳理(三)
 点击免费领取中考核心考点资料!
点击免费领取中考核心考点资料!
第三部分 常见的盐
1. 盐的定义:
指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物①食盐的主要成分②物理性质:白色晶体、易溶于水、有咸味,水溶液呈中性③化学性质:与硝酸银溶液反应生成AgCl白色沉淀④用途:作调味品、防腐剂、融雪剂,重要的化工原料,农业上用NaCl溶液选种,用于配制生理盐水等①俗称:纯碱或苏打②物理性质:白色粉末、易溶于水③化学性质:溶液显碱性,能使紫色石蕊溶液变蓝,使无色酚酞溶液变红④工业制取:采用制碱专家侯德榜发明的“侯氏联合制碱法”制得⑤用途:广泛应用于玻璃、造纸、纺织、洗涤剂等的生产①俗称:小苏打②物理性质:白色粉末、能溶于水③化学性质:不稳定,受热易分解,水溶液显碱性④用途:作发酵粉、用于治疗胃酸过多症、作灭火剂的原料等①大理石、石灰石的主要成分②物理性质:纯净物为白色粉末、不溶于水③化学性质:高温下分解,化学方程式为:

3. 常见盐的溶解性
④用途:实验室用来制取CO2,用作建筑材料、补钙剂等①钾盐、钠盐、铵盐、硝酸盐均易溶于水②盐酸盐中,只有AgCl不溶于水也不溶于酸③硫酸盐中,BaSO4不溶于水也不溶于酸,Ag2SO4、CaSO4微溶于水④碳酸盐中,Na2CO3、K2CO3、(NH4)2CO3易溶,MgCO3微溶,其余不溶置换反应规律:盐(可溶)+金属(较活泼)→新金属(较不活泼)+新盐

(2)与酸反应
举例:
规律:盐+酸→新酸+新盐(碳酸盐+酸→新盐+H2O+CO2↑)(复分解反应)
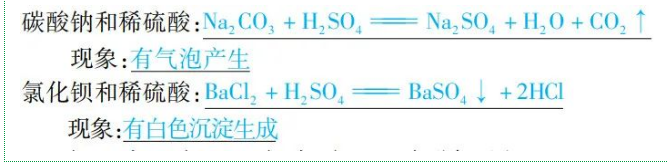
(3)与碱反应
举例:
规律:盐(可溶)+碱(可溶)→新碱+新盐(复分解反应)

(4)与某些盐反应
举例:
规律:盐(可溶)+盐(可溶)→两种新盐(复分解反应)

编辑推荐:




