2023年初中化学溶解度曲线解决方法
 点击免费领取中考核心考点资料!
点击免费领取中考核心考点资料!
初中化学溶解度曲线解决方法
溶解度曲线的应用
一、
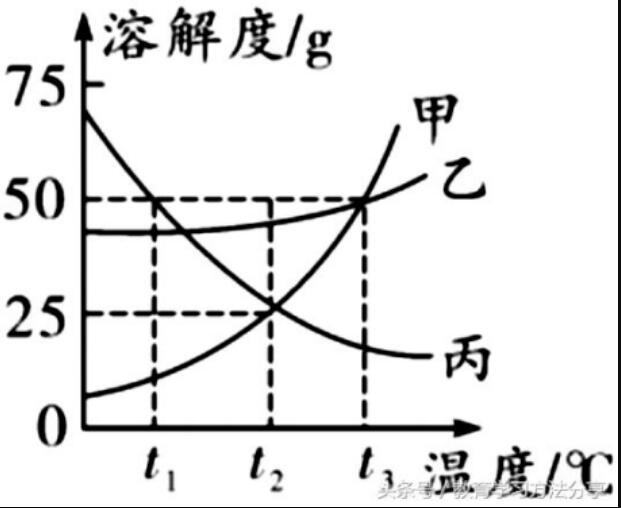
1.找物质的溶解度
秘招
该物质在某一温度下曲线上点对应的纵坐标值,如丙物质在t1℃时的溶解度为50 g。
2.比较不同物质在同一温度下溶解度的大小
秘招
同一温度下,位于上方曲线对应物质的溶解度大于下方曲线对应物质的溶解度。如0 ~t3℃,乙的曲线在甲的上方,溶解度大小为乙>甲;0 ~ t2℃,丙的曲线在甲的上方,溶解度大小为丙>甲;t2℃时,甲、丙两曲线相交,此时溶解度大小为甲=丙。
特别提醒:比较溶解度,温度是前提
3.判断物质的溶解度随温度变化的趋势
秘招
分析溶解度曲线的坡度及走向,从左向右看曲线的走势是向上、向下还是平缓。常见物质的溶解度曲线可分为:
陡升型
1.:表示物质的溶解度随温度升高明显增大,如甲;
缓升型
2.:表示物质的溶解度随温度的升高增大不明显,如乙;
下降型
3.:表示物质的溶解度随温度的升高而下降,如丙。
4.饱和溶液与不饱和溶液的判断与转化
秘招
以溶解度曲线为界限,曲线上及上方的点代表该物质对应温度下的饱和溶液,曲线下方的点代表该物质对应温度下的不饱和溶液。对于饱和溶液与不饱和溶液的转化方法如下:
a. 对于大多数固体(溶解度随温度升高而增大的物质):
b. 对于极少数固体(溶解度随温度升高而减小的物质):
⑤溶液中溶质质量分数的计算及大小比较
秘招
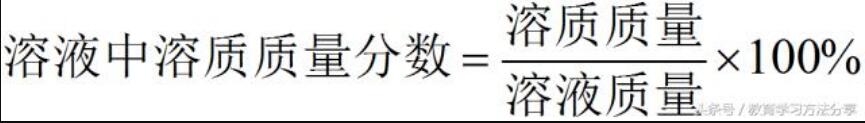
,
若溶液为饱和溶液,则:

,
通过计算可比较溶质质量分数的大小。对于饱和溶液的溶质质量分数有:当0< t < t3时,甲、乙两种饱和溶液的溶质质量分数为乙>甲;当t = t3时,甲、乙两种饱和溶液的溶质质量分数相等;t > t3时,甲、乙两种饱和溶液的溶质质量分数为甲>乙。
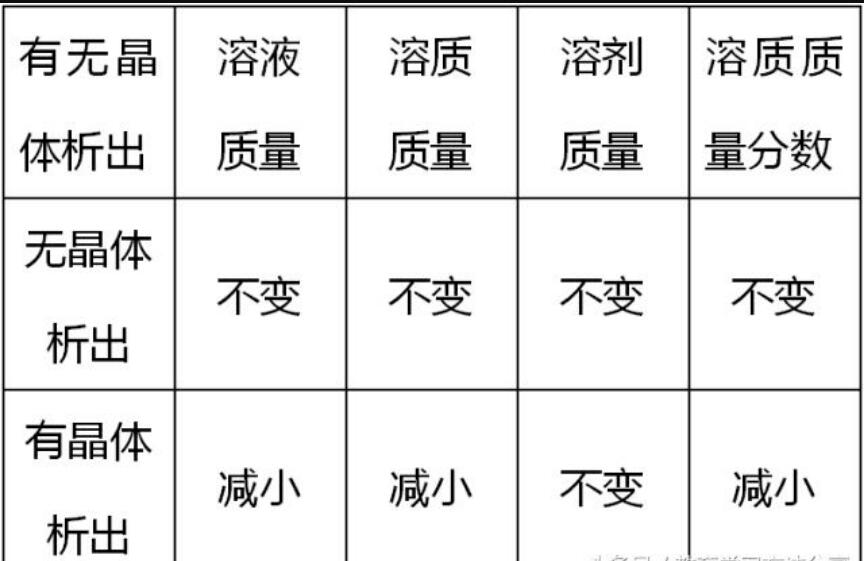
⑥温度变化时溶液质量、溶剂质量、溶质质量及溶质质量分数的变化
秘招1
根据有无晶体析出
秘招2
根据曲线走向(饱和溶液适用)

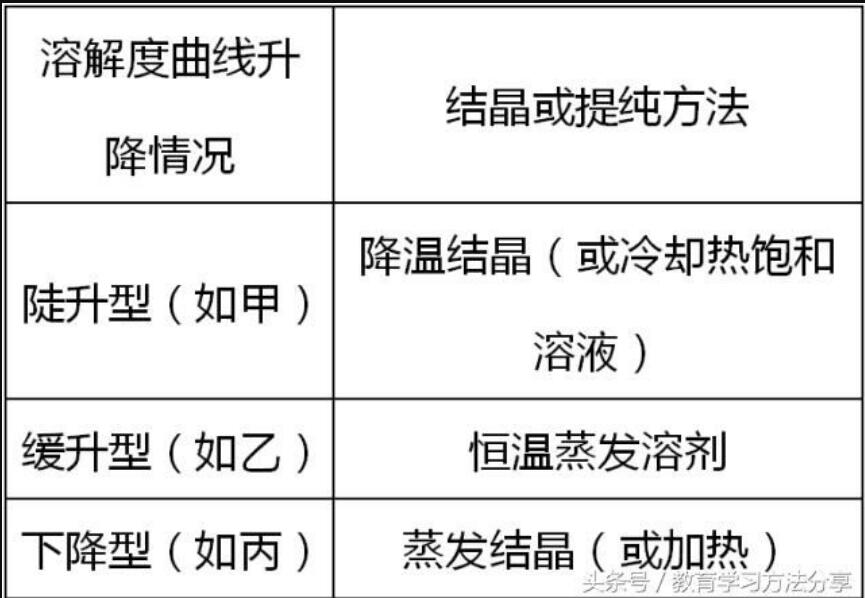
⑦判断物质结晶或提纯的方法
秘招
二、溶解度表
下表是KCl和KNO3在不同温度下的溶解度。
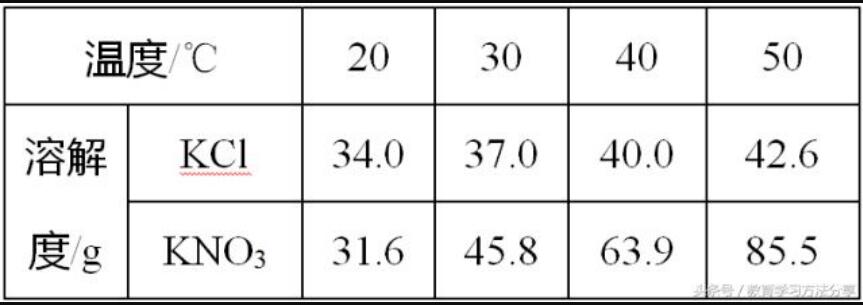
判断两种物质的溶解度变化趋势和两物质溶解度相等的温度范围。
秘招
解决这类问题,可以通过对比同一物质在不同温度的溶解度变化,从而判断物质溶解度的变化趋势。通过比较两物质在同一温度的溶解度大小,如20℃时,KCl的溶解度大于KNO3的溶解度,30℃时,KNO3的溶解度大于KCl的溶解度,故在20℃~30℃的某一温度下,二者的溶解度相等。



