2023年初中化学总复习——化学实验综合
初中总复习——化学实验综合
【知识掌握】
【知识点精析】
1. 常见物质的名称、化学式、俗称及主要物理性质
名称
化学式
俗称
主要物理性质
硫
S
硫磺
黄色固体,不溶于水;易溶于有机溶剂。
二氧化碳
CO2
固体俗称干冰
无色气体、能溶于水、密度比空气大,固体干冰易升华。
一氧化碳
CO
煤气
无色、无味气体、难溶于水,
密度比空气略小,有毒性。
甲烷
CH4
沼气、坑气
无色、无味气体,极难溶于水,
密度小于空气。
乙醇
C2H5OH
酒精
无色透明,具有特殊气味的易
挥发的液体,可与水任意互溶。
乙酸
CH3COOH
醋酸、冰醋酸
无色有刺激性酸味的液体,易
溶于水,固体称冰醋酸。
氧化钙
CaO
生石灰
白色固体,易吸水,有腐蚀性。
氧化铁
Fe2O3
铁锈、赤铁矿
红色固体,不溶于水。
四氧化三铁
Fe3O4
磁铁矿
黑色固体,不溶于水。
氢氧化钠
NaOH
火碱、烧碱、苛性钠
白色固体,极易溶于水,易潮
解,有强腐蚀性。
氢氧化钙
![]()
熟石灰、消石灰、
石灰水
白色粉末状固体,微溶于水,有
腐蚀性。
碳酸钠
Na2CO3
纯碱、口碱、苏打
白色粉末状固体,易溶于水且吸
湿结块。
碳酸钠晶体
Na2CO3·10H2O
无色晶体,易失水风化。
碳酸氢钠
NaHCO3
小苏打
白色晶体,易溶于水,但溶解度
比
![]()
小。
氯化钠
![]()
食盐
碳酸钙
![]()
石灰石、大理石
白色固体,不溶于水。
硫酸铜
![]()
白色粉末状固体,溶于水,其水
溶液为蓝色。
硫酸铜晶体
![]()
蓝矾、胆矾
蓝色晶体。
高锰酸钾
![]()
灰锰氧
紫色有光泽晶体,溶于水,其水
溶液为紫色。
碱式碳酸铜
![]()
铜绿
绿色粉末状固体,不溶于水。
氯化银
![]()
新制得为白色凝乳状沉淀,不溶
于稀硝酸。
硫酸钡
BaSO4
天然产称重晶石
白色固体,不溶于水,不溶于稀
硝酸。
氢氧化铁
![]()
新制得为红褐色沉淀。
氢氧化铜
![]()
新制得为蓝色沉淀。
2. 几种常见药品的存放
药品
性质
保存方法
白磷
着火点低,易自燃,不跟水反应
放入冷水中
浓硫酸
易吸收空气中的水分(吸水性)
放入玻璃瓶内,瓶塞要严
浓盐酸
易挥发
放入玻璃瓶内,瓶塞要严
浓硝酸
易挥发
放入玻璃瓶内,瓶塞要严
氧化钙
易吸水,易与空气中二氧化碳反应而变质
密封于干燥试剂瓶中
固体氢氧化钠
易潮解,易与空气中二氧化碳反应而变质
密封于干燥试剂瓶中
碱溶液的玻璃瓶应用橡胶塞密封。
3. 物质的检验
(1)常见气体的检验
物质
检验的方法、步骤
现象
化学反应原理
备注
氧气
![]()
带火星的木条伸入瓶中
木条复燃
C+O2
![]()
CO2
氢气
![]()
⑴点燃
⑵ 火焰上方罩一冷而干燥的烧杯。
⑴ 产生淡蓝色火焰。
⑵ 烧杯壁上有水雾或水珠生成。
2H2+O2
![]()
2H2O
不纯时有爆鸣声
二氧化碳
![]()
⑴ 燃着的木条伸入集气瓶
⑵ 加入澄清石灰水
⑴ 木条熄灭;
⑵ 石灰水变浑浊。
Ca(OH)2+CO2==CaCO3↓+H2O
一氧化碳
![]()
⑴ 点燃;
⑵ 火焰上方罩一干燥烧杯;
⑶ 烧杯中注入澄清石灰水。
⑴ 产生蓝色火焰;
⑵ 烧杯壁无水珠;
⑶ 石灰水变浑浊。
2CO+O2
![]()
CO2
Ca(OH)2+CO2==CaCO3↓+H2O
不纯时有爆鸣声
甲烷
![]()
⑴ 点燃;
⑵ 火焰上方罩一干燥烧杯;
⑶ 烧杯中注入澄清石灰水。
⑴ 产生明亮的蓝色火焰;
⑵ 烧杯壁有水珠;
⑶ 石灰水变浑浊。
CH4+2O2
![]()
CO2+2H2O
Ca(OH)2+CO2==CaCO3↓+H2O
不纯时有爆鸣声
氯化氢
![]()
⑴ 有刺激性气味
⑵ 用润湿的蓝色石蕊试纸
⑶ 在空气中有白雾
⑷ 通入
![]()
溶液中
⑵ 使蓝色石蕊试纸变红。
⑷
![]()
溶液产生白色沉淀。
HCl=H++Cl-
AgNO3+HCl=AgCl↓+HNO3
氨气
![]()
⑴ 有特殊刺激性气味;
⑵ 利用湿润的红色石蕊试纸。
⑴ 有氨臭味;
⑵ 湿润石蕊试纸由红色变蓝色。
![]()
![]()
氮气
![]()
⑴ 燃着木条伸入集气瓶;
⑵ 加入澄清石灰水
⑴ 木条熄灭;
⑵ 石灰水依然澄清。
(2)几种重要物质的检验
物质
所用试剂
检验的方法、步骤
现象
化学反应实例
酸
![]()
⑴ 紫色石蕊试液
取少量酸于试管并加入几滴石蕊试液。
石蕊试剂由紫色变为红色。
⑵ 无色酚酞试液
取少量酸于试管并加入几滴酚酞试液。
无色酚酞试液不变色。
⑶ PH试纸
蘸取少量酸滴在
![]()
试纸上。
![]()
碱
![]()
⑴ 紫色石蕊试液
取少量碱液于试管中并加入几滴石蕊试液。
石蕊试剂由紫色变为蓝色。
⑵ 无色酚酞试液
取少量碱液于试管中并加入几滴酚酞试液。
无色酚酞试液由无色变为红色。
⑶ PH试纸
蘸取少量碱液滴在
![]()
试纸上。
![]()
盐酸及可溶性氯化物
![]()
![]()
试剂和稀
⑴ 取少量待测液于试管中
⑵ 滴入几滴
![]()
试剂并滴加稀
产生不溶于稀
![]()
的白色凝乳状沉淀。
![]()
![]()
硫酸及可溶性硫酸盐
![]()
![]()
试剂和稀
⑴ 取少量待测液于试管中
⑵ 滴入几滴
![]()
试剂并滴加稀
生成不溶于稀
![]()
的白色沉淀。
![]()
![]()
碳酸盐
![]()
![]()
或稀,澄清石灰水
⑴ 取少量待测固体或溶液于试管;
⑵ 加入几滴稀
![]()
或稀;
⑶ 将生成的气体通入澄清石灰水。
冒出气泡,气体能使澄清石灰水变浑浊。
![]()
![]()
![]()
![]()
铵盐
![]()
⑴ 碱或碱液
⑵ 红色石蕊试纸
⑴ 取少量待测固体或溶液于试管;
⑵ 加入碱或碱液共热;
⑶ 将产生的气体接触湿润的红色石蕊试纸。
⑴ 有刺激性气体生成;
⑵ 该气体使湿润的红色石蕊试纸变蓝。
![]()
![]()
![]()
4. 常见气体的实验室制取和物质性质的实验
(1)气体的发生装置
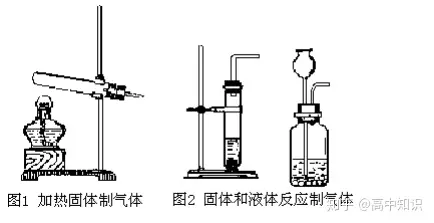
(2)气体的收集装置
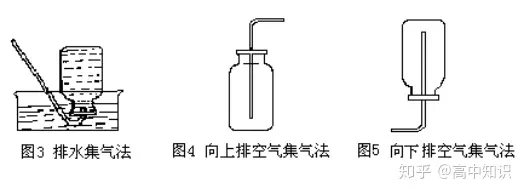
① 排水集气法
② 向上排空气集气法
③ 向下排空气集气法(集气瓶口向下)。
(3)气体验纯与验满方法
(4)实验室制取氧气、氢气和二氧化碳使用的药品及反应原理
气体
药品
反应原理
O2
氯酸钾、二氧化锰或高锰酸钾
![]()
↑,↑
H2
锌粒、稀硫酸
Zn+H2SO4(稀)===ZnSO4+H2↑
CO2
大理石或石灰石、稀盐酸
CaCO3+2HCl===CaCl2+H2O+CO2↑
5. 常见气体杂质的除法
气体杂质
方法或试剂
H2
通过灼热的氧化铜,然后再除去产生的水蒸气。
CO
通过灼热的氧化铜,然后再除去产生的
![]()
O2
通过炽热的铜网。原理:
![]()
CO2
通过澄清石灰水或
![]()
溶液。(后者吸收效果更好)
![]()
通过无水硫酸铜或浓硫酸。(后者在除水时常用)
![]()
通过
![]()
溶液或等碱性溶液中(后者吸收效果好)
6. 常见物质的分离和提纯
(1)过滤法
(2)蒸发法
(3)结晶法
(4)沉淀法
(5)气化法
(6)转化法
(7)溶解法
(8)吸收法
7. 课本上的重点实验
(1) 空气中氧气含量的测定
(2) 燃烧的条件
(3) 分子的运动
(4) 水的组成
(5) 验证质量守恒定律



