2023年初中化学酸、碱、盐的小总结
 点击免费领取中考核心考点资料!
点击免费领取中考核心考点资料!
一、酸碱指示剂
1.定义:能跟酸或碱的溶液起作用而显示不同颜色的物质叫做酸碱指示剂。
2. 常见的酸碱指示剂有紫色石蕊溶液和无色酚酞溶液。
3. 紫色石蕊溶液遇酸溶液(含H+的溶液)变红,遇碱溶液(含OH-的溶液)变蓝,在中性溶液中呈紫色。
4.无色酚酞溶液遇酸溶液不变色,在中性溶液中不变色,遇碱溶液变红。
5.注意: 并非所有的盐溶液都是中性的。
水溶液呈碱性的盐:纯碱、小苏打等。
水溶液呈酸性的盐:硫酸铜、硫酸氢钠等。
二、干燥剂
1. 我们学过的干燥剂有氢氧化钠、浓硫酸、氧化钙、氯化钙等。
氢氧化钠易潮解;浓硫酸具有吸水性;而氧化钙可以与水反应:CaO+H2O=Ca(OH)2
2.氢氧化钠
氢氧化钠等碱性干燥剂不能干燥氯化氢、二氧化碳、二氧化硫等酸性气体。
3.浓硫酸
浓硫酸等酸性干燥剂不能干燥氨气等碱性气体。
三、复分解反应
定义:两种化合物互相交换成分,生成另外两种化合物的反应叫复分解反应。
2. 特点:交换成分,价态不变。
3. 反应发生的条件:生成难电离的物质(水、气体或沉淀)。
四、酸的定义和分类
酸:物质溶于水时,形成的阳离子全部是H+的化合物。
由于酸、碱、盐溶于水时会电离出阴、阳离子,所以酸、碱、盐的水溶液具有导电性。

酸的电离:公式[公式],公式[公式]
五、常见的酸

注: 浓硫酸能将纸张、木材、布料、皮肤中的氢、氧元素按水的组成比脱去,这种作用通常叫做脱水作用。
盐酸、硝酸、醋酸具有挥发性;碳酸不稳定,容易分解成二氧化碳和水。
硝酸、硝酸银见光易分解,所以它们要放在棕色试剂瓶中。
浓硫酸的稀释操作:
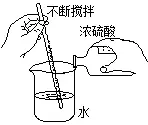
六、酸的化学性质
酸有相同的化学性质是因为酸在水中都能电离出公式[公式],有不同的化学性质是因为能电离出的酸根离子不同。
1.酸溶液能使酸碱指示剂变色:使紫色石蕊溶液变红。
2.酸+活泼金属 → 盐+氢气(置换反应)
a) 这里不包括浓硫酸和硝酸。
b) 示例:公式[公式]和公式[公式]
【现象】铁表面有气泡产生;溶液由无色逐渐变为浅绿色(公式[公式]的盐溶液呈浅绿色)。
3.酸+金属氧化物 → 盐+水(复分解反应)
a) 金属氧化物可以是活泼金属的氧化物和不活泼金属的氧化物。因为生成物有水,符合复分解反应的发生条件,所以反应一定发生。
b) 示例1:公式[公式]和公式[公式]
【现象】铁锈逐渐溶解消失;溶液由无色逐渐变成黄色(公式[公式]的盐溶液呈黄色)。
c) 示例2:公式[公式]和公式[公式]
【现象】黑色粉末逐渐溶解消失;溶液由无色逐渐变成蓝色(公式[公式]的盐溶液呈蓝色)
4.酸+碱 → 盐+水(复分解反应、中和反应)
5.酸+盐 → 新酸+新盐(复分解反应)
a) 反应发生的条件:①新酸是碳酸等弱酸(强酸制弱酸); ②如果新酸不是弱酸,新盐必须是沉淀。
b)碳酸盐都能与强酸反应(形成气体):公式[公式](碳酸不稳定,分解成二氧化碳和水)
c)除硫酸钡以外的钡盐都能与硫酸反应:公式[公式](注意:HCl是稀盐酸,不写↑)
d)硝酸银能与盐酸反应:公式[公式]
七、碱的定义和分类
碱:物质溶于水时,形成的阳离子全部是公式[公式]的化合物。

四大强碱都可以溶于水,但弱碱不能溶于水。氨水是氨气溶于水形成的液体。
在初中化学范围内,只有氢氧化铜是蓝色沉淀,氢氧化铁是红褐色沉淀。
氨水的电离是公式[公式],所以氨水也是碱。
钾、钠、钙的氧化物能与水反应生成相应的碱。如:公式[公式]
八、常见的碱
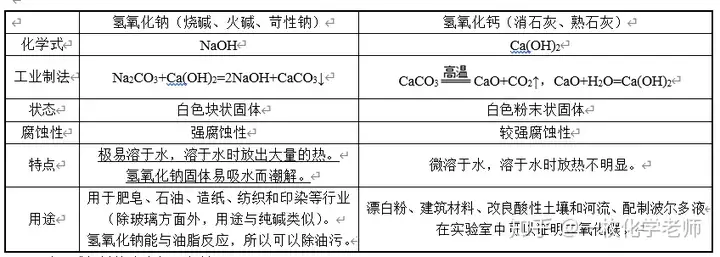
酸、碱包括其溶液都要密封。
澄清的石灰水就是氢氧化钙的水溶液。
氢氧化钠必须密封有两个原因:① 吸水性;② 能与空气中的二氧化碳反应:公式[公式]。
九、碱的化学性质
碱有相同的化学性质是因为不同的碱溶液中都含有相同的公式[公式]。
1.碱溶液(四大强碱的溶液、氨水)能使指示剂变色:使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
由于弱碱不溶于水,所以弱碱不能使指示剂变色(氨水除外)。
2.碱+非金属氧化物 → 盐+水(复分解反应)
a) 反应发生的条件:① 碱是四大强碱; ② 非金属氧化物是二氧化碳、二氧化硫、三氧化硫等(高中阶段还会有其他非金属氧化物)。
b) 根据条件我们可以写出十二个化学方程式,但必须掌握的四个化学方程式是:
公式[公式](用氢氧化钠溶液吸收二氧化碳)
公式[公式]
公式[公式]
公式[公式](检验二氧化碳;石灰墙“出汗”)
3.碱+酸 → 盐+水(复分解反应、中和反应)
在碱的通性中,弱碱只有该性质。
4.碱+盐 → 新碱+新盐(复分解反应)
a) 反应发生的条件:① 反应物能溶于水(包括氢氧化钙,不包括其他微溶于水的物质); ② 新碱是氨水; ③ 若新碱不是氨水,新碱和新盐中至少有一个沉淀。
b)铵盐一定能与四大强碱反应。
c) 新碱是沉淀:
蓝色沉淀 –公式[公式]
红褐色沉淀 –公式[公式]
白色沉淀 –公式[公式]
d) 新盐是沉淀:
公式[公式]
公式[公式]
e) 蓝白沉淀:公式[公式]
f) 红白沉淀:公式[公式]
g)波尔多液(注:波尔多液不是溶液):公式[公式]
弱碱在加热的条件下会分解成金属氧化物和水。如
![]()
但需要注意的是,强碱没有该性质,该性质不属于碱的通性。
十、氢氧化钠和氢氧化钙变质
1. 氢氧化钠变质
氢氧化钠变质是因为与空气中的二氧化碳反应生成碳酸钠。
证明方法:
a)取样,加过量的稀盐酸,如果有气泡产生,说明氢氧化钠已经变质:
公式[公式]和公式[公式]
b)取样,加氢氧化钙溶液,如果有白色沉淀产生,说明氢氧化钠已经变质:
公式[公式]
c)取样,加氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明NaOH已经变质:
公式[公式]或公式[公式]
2. 氢氧化钙变质
氢氧化钙变质是因为与空气中的二氧化碳反应生成碳酸钙。
证明方法:取样,加入过量的稀盐酸,如果有气泡产生,说明氢氧化钙已经变质:
公式[公式]
公式[公式]
3. 氢氧化钠固体和氢氧化钙固体变质时,固体质量都会增加。
十一、氢氧化钠和氢氧化钙部分变质
1. 氢氧化钠部分变质的证明方法:
①取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:
公式[公式]或公式[公式]
② 过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
2. 氢氧化钙固体部分变质的证明方法:
①取样,加适量水使固体完全溶解,加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在:
公式[公式]
②另取少量固体,加氯化铵(或硫酸铵)研磨,如果闻到刺激性氨味,说明氢氧化钙存在,氢氧化钙部分变质:公式[公式]或公式[公式]
十二、中和反应
定义:酸和碱作用生成盐和水的反应。
酸和强碱反应,一般没有明显的实验现象(沉淀、气泡、不溶物溶解消失、溶液颜色变化),所以为了观察反应是否发生,需要借助酸碱指示剂。
如公式[公式],反应的时候要进行以下操作:
①在烧杯中加入氢氧化钠溶液;
②滴入几滴酚酞溶液;
③用滴管慢慢地滴入稀盐酸,并不断用玻璃棒搅拌(如果容器是试管,就直接振荡);
④溶液由红色刚刚褪成无色时,说明氢氧化钠和盐酸恰好完全反应。
(注意是先加碱溶液,再加指示剂,然后才加酸)
做上述实验时,如果在实验过程中忘加酚酞,在实验结束后再加酚酞溶液,发现酚酞不变色,会有两种情况:酸碱恰好完全反应或者酸过量。这时加入碳酸钙固体,如果有气泡产生,说明酸过量;如果没有气泡产生,说明恰好完全反应。
虽然不能用酚酞溶液鉴别酸性溶液和中性溶液,但借助一种碱溶液,就能将酸性和中性溶液区分出来。
在所有的复分解反应中,中和反应优先发生,并且反应可以瞬时完成。
中和反应是放热的反应。
中和反应的应用
熟石灰改良酸性土壤(在缺少熟石灰的情况下,用生石灰也可以)。
熟石灰改良酸性河流(处理硫酸厂的污水:公式[公式])。
铁粉、蛋壳(主要成分是碳酸钙)也可改良酸性河流,但它们不属于中和反应。
碳酸水改良碱性土壤。
用含氢氧化铝或氢氧化镁的药物中和过多的胃酸:
公式[公式]
小苏打、墨鱼骨粉(主要成分是碳酸钙)也可以治疗胃酸过多,但它们不属于中和反应。
被蚊虫叮咬时涂含氨水(或者是牙膏、肥皂水)的药物。
中和反应同氧化反应、还原反应一样,是特征反应,不属于四大基本反应类型。
十三、酸碱度
溶液的酸碱度用pH表示。pH的范围通常在0~14之间。
酸性溶液的pH < 7,中性溶液的pH = 7,碱性溶液的pH > 7。
公式[公式]的浓度越大,溶液的酸性越强,pH越小;公式[公式]的浓度越大,溶液的碱性越强,pH越大。
溶液中公式[公式]或公式[公式]的浓度改变,则pH会相应改变。
测定pH的最简单方法是使用pH试纸。
pH试纸的使用步骤:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒将待测液体滴到pH试纸上,将pH试纸显示的颜色与标准比色卡比较。
使用pH试纸时的注意事项:
①不能把pH试纸浸在待测液体中。
②pH试纸不能用水润湿。
③pH试纸测出的pH值是整数。
十四、 盐的概述
1. 盐的定义:由金属离子(或公式[公式])和酸根离子形成的化合物。
2. 几种常见的盐
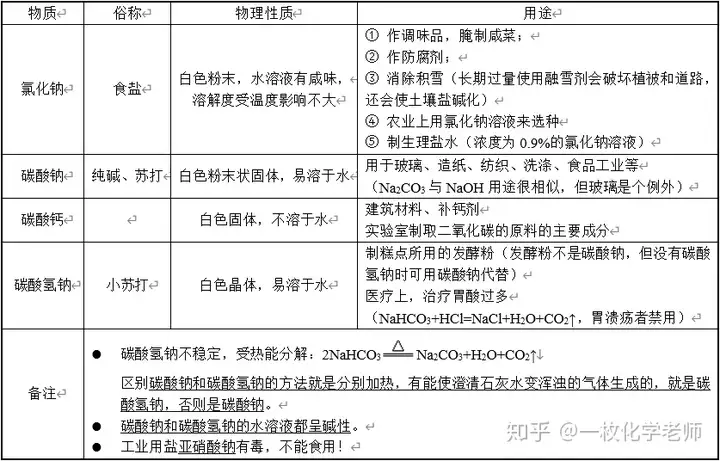
3. 消毒用盐
游泳池一般用硫酸铜消毒。
医疗上一般用高锰酸钾消毒。
过去习惯用氯气给自来水消毒,现在用二氧化氯消毒。
4. 侯氏制碱法:又名联合制碱法。主要产物是碳酸钠,此外还有副产品是氯化铵。
5. 钠离子可以维持细胞内外的水分分布,促进细胞内外物质交换;氯离子可以促生盐酸、帮助消化,增进食欲。
6. 氯化钠等溶于水后,会使水的凝固点降低,以达到溶雪的目的。氯化钠作为融雪剂,对植物有害,会腐蚀桥梁等,所以现在逐渐被绿色融雪剂代替。
十五、 粗盐提纯
1. 粗盐的初步提纯只是去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
2. 粗盐中由于含有氯化镁、氯化钙等杂质,易吸收空气中的水分而潮解。无水氯化钙可用作干燥剂。
3.实验步骤:溶解、过滤、蒸发、回收。
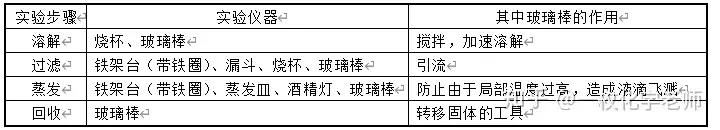
4. 蒸发时要经常用玻璃棒搅拌液体,防止由于局部温度过高造成液滴飞溅。
5. 当水接近全部蒸发时熄灭酒精灯,停止加热,利用余热使剩余水分蒸发。
十六、盐的化学性质
1.盐(可溶)+ 金属1 → 金属2 + 新盐(金属1比金属2活泼,金属不是钾、钙、钠)
2.盐 + 酸 → 新盐 + 新酸
3.盐 + 碱 → 新盐 + 新碱(反应物需都可溶,且满足复分解反应的条件)
4.盐 + 盐 → 两种新盐(反应物需都可溶,且满足复分解反应的条件)
注:部分不溶于水的盐只具有性质2。
氯化银、硫酸钡既不溶于水,也不溶于酸(不溶于酸就是不与酸反应)。
十七、 酸、碱、盐的溶解性(室温)
1. 酸:大多数都可溶。
2. 碱:只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉淀。
3. 盐:钾盐、钠盐、铵盐、硝酸盐都可溶。
4. 氯化物除氯化银不溶于水外,其余多数均易溶于水(氯化不溶银亚汞)。
5. 硫酸盐除硫酸钡不溶于水,硫酸银、硫酸钙微溶于水外,其余多数易溶于水(硫酸不溶钡和铅)。
6.碳酸盐只有碳酸铵、碳酸钾、碳酸钠易溶于水。



